015. Preparación de fármacos antineoplásicos en los servicios de farmacia hospitalaria: exposición a agentes citostáticos. (2014)
Descripción de la situación de trabajo
Los citostáticos son medicamentos con mecanismos de acción muy diversos pero con la característica común de interrumpir el ciclo celular en alguna de sus fases. Esta propiedad permite utilizarlos en el tratamiento de enfermedades neoplásicas. El proceso de preparación de fármacos citostáticos se realiza generalmente en los servicios de farmacia de los hospitales. Tras validar la prescripción médica, y partiendo del producto comercial, se realizan las manipulaciones necesarias (reconstitución, mezclas, diluciones, etc.) para obtener el medicamento en las condiciones adecuadas para su administración al paciente.
Con el fin de trabajar en condiciones asépticas y proteger al trabajador y al ambiente, las preparaciones de agentes citostáticos se realizan en cabinas de seguridad.
Ver figura 1, "Preparación de fármacos citostáticos en cabina de seguridad".
Los manipuladores de citostáticos, en caso de utilizar una cabina inadecuada, con un deficiente funcionamiento de la misma y/o debido a procedimientos de trabajo inseguros o contaminación de superficies, pueden estar expuestos a:
- la inhalación de aerosoles y vapores (menos probable) que se pueden desprender durante la preparación o debido a la rotura de viales y ampollas,
- la penetración del citostático a través de la piel y mucosas por el contacto directo con derrames o con objetos contaminados, y
- la penetración parenteral debida a pinchazos producidos por agujas o cortes por ampollas y viales rotos.
Agentes químicos
Los citostáticos son un grupo heterogéneo de sustancias de distinta naturaleza química. Por su mecanismo de acción se clasifican en :
- Agentes alquilantes, por ejemplo: ciclofosfamida, clorambucilo, carmustina o busulfán.
- Antimetabólicos, por ejemplo: metotrexato o 5-fluorouracilo.
- Complejos de platino como cisplatino.
- Antibióticos citostáticos como amsacrina.
- Productos de origen natural, alcaloides de la vinca (vincristina, vinblastina) y del podófilo (etopósido).
- Otros antineoplásicos, por ejemplo: aminoglutetimida o mitotano.
En el anexo 2 se presenta un listado no exhaustivo de los principales citostáticos, incluyendo el modo de acción, su clasificación según la IARC (International Agency for Research on Cancer) y el análisis preclínico sobre seguridad que se recoge en las fichas técnicas de los medicamentos autorizados en España por la Agencia Española de Medicamentos y Productos Sanitarios (AEMPS).
Daños para la salud
Aunque la situación de trabajo descrita comporta también otros riesgos, aquí solo se tratarán los que se refieren a los efectos para la salud derivados de la exposición a agentes citostáticos.
Las vías de entrada principales para estas sustancias son la inhalatoria para aerosoles y vapores generados a temperatura ambiente y la dérmica (piel, mucosas).También pueden penetrar por vía parenteral cuando se producen pinchazos y cortes, y por vía oral, por ejemplo, por contacto con guantes contaminados (poco frecuente).
Los citostáticos administrados como medicamentos, debido a su mecanismo de acción, resultan por sí mismos carcinógenos, mutágenos y/o tóxicos para la reproducción, porque además de afectar a las células cancerosas, pueden afectar a las células normales sobre todo de tejidos de rápida renovación. Otras acciones adversas que pueden presentar estos agentes son: alteración corneal, cardiotóxica, hepatotóxica, neurotóxica, nefrotóxica, hemorrágica, vesicante, irritante de piel y mucosas, emetizante y hematológica. Cada citostático puede producir uno o varios de los efectos citados.
Los efectos secundarios en pacientes tratados con citostáticos representan un indicador del riesgo potencial que puede suponer para los trabajadores que los manipulan.
La exposición laboral a los citostáticos puede producir efectos locales e inmediatos, asociados a exposiciones accidentales, que cursan con afectación cutánea, de mucosas o sistémica (si se ha producido una rápida absorción) y también efectos a largo plazo, producidos por exposiciones continuas a bajas dosis que durante largos periodos pueden ser subclínicos, por lo que resulta más difícil demostrar la relación causa-efecto entre la exposición laboral y sus efectos sistémicos.
Las manifestaciones que se pueden presentar en el personal manipulador de citostáticos son:
- afectaciones cutáneas y de mucosas como pigmentaciones, dermatitis, prurito, urticaria, quemaduras o mucositis. La acción irritante puede variar desde una irritación local hasta necrosis tisular, ulceración cutánea y necrosamiento de la zona,
- reacciones de hipersensibilidad inmediata y de anafilaxia sistémica (de especial relevancia),
- afectaciones del tracto respiratorio como irritación y broncoespasmo,
- manifestaciones como cefaleas, náuseas, vértigos, aturdimiento, malestar general o alopecia.
También se han documentado efectos como:
- mutagenicidad urinaria y presencia de metabolitos en orina de agentes citostáticos,
- afectaciones citogenéticas heterogéneas; aberraciones cromosómicas y atipias celulares,
- carcinogenicidad (relacionándolos con cáncer de vejiga, carcinoma nasofaríngeo y leucemia),
- abortos espontáneos y malformaciones, alteraciones en la menstruación e infertilidad,
- daño hepatocelular,
- sabor metálico, signos de irritación y emesis.
Factores de riesgo más importantes
Los factores de riesgo más importantes que aumentan la probabilidad de que se materialicen los daños para la salud derivados de la exposición a los agentes citostáticos, son:
- La toxicidad inherente de cada citostático.
- Presentaciones comerciales poco adaptadas a las dosis habituales que precisan de manipulación previa a su administración.
- Envases primarios (viales, ampollas) contaminados externamente.
- Utilización de cabinas inadecuadas.
- Equipos e instalaciones no adecuadas:
- Ausencia de área específica aislada para las preparaciones.
- Deficiente control ambiental en el local de trabajo (aire, número de renovaciones de aire por hora, temperatura, presión).
- Material de protección no disponible, insuficiente o inadecuado.
- Número de preparaciones que se realizan por trabajador, relacionado con el tiempo de exposición.
- Procedimientos de trabajo y limpieza inadecuados o inexistentes.
- Deficiente adiestramiento de los manipuladores.
Otros factores a considerar son las circunstancias individuales de los trabajadores como:
- Alergia a los agentes citostáticos y/o patología dermatológica importante.
- Que planeen un embarazo a corto plazo.
- Que tengan historia de abortos y/o hijos con malformaciones congénitas.
- La situación de embarazo, periodo de lactancia natural y cualquier otra condición de susceptibilidad particular de carácter temporal.
- Que trabajen con radiaciones ionizantes.
- Que previamente hayan recibido tratamientos citostáticos o inmunosupresores y/o radiaciones.
- Que se sospeche daño genético o estén alterados determinados parámetros biológicos.
- Trastornos de inmunodeficiencia.
- Que hayan sufrido accidentes con citostáticos y se encuentren en estudio.
- La existencia de patologías susceptibles de empeorar en contacto con citostáticos.
Medidas Preventivas
MEDIDAS DE ELIMINACIÓN DEL RIESGO
Deben ser las primeras a considerar cuando la naturaleza de la actividad lo permita. En este caso, se podría considerar la adquisición de medicamentos listos para su administración al paciente, como por ejemplo, las jeringas precargadas.
MEDIDAS DE REDUCCIÓN Y CONTROL DEL RIESGO
Utilización de cabinas adecuadas
La preparación de citostáticos se debe realizar en equipos de contención que proporcionen los más altos niveles de protección al operario pero también al medicamento y al ambiente. La contención requerida la pueden proporcionar cabinas de seguridad que cumplan ciertos requisitos. El trabajador y el ambiente tienen que ser protegidos frente a la contaminación por los medicamentos citotóxicos y el medicamento frente a la contaminación microbiológica principalmente.
Las cabinas de seguridad adecuadas pueden ser cabinas totalmente cerradas como los aisladores de laboratorio y las Cabinas de Seguridad Biológica (CSB) clase III o con acceso abierto en su parte frontal como las CSB clase II específicas para el trabajo con citostáticos.
Los aisladores de laboratorio están diseñados para proteger al operario y al entorno de exposiciones a sustancias peligrosas como los agentes citostáticos y al medicamento de la contaminación cruzada y la procedente del exterior. Pueden trabajar a presión negativa o positiva (a presión negativa es óptima la protección del trabajador, a presión positiva es óptima la protección del producto). La elección dependerá de cada caso concreto aunque en principio es recomendable trabajar a presión negativa.
Estos equipos proporcionan flujo laminar vertical estable en la zona de trabajo que minimiza la contaminación cruzada. Disponen de cajas de transferencia para introducir y sacar los productos de la zona de trabajo y puertos de acceso con guantes. Incorporan filtración en la entrada y extracción del aire y, en algunos casos, bajo la superficie de trabajo. Son filtros absolutos de muy alta eficacia grupo H (HEPA) generalmente de clase H14, o bien filtros de ultra baja penetración grupo U (ULPA) según norma UNE-EN 1822-1:2010. El 100% del aire del interior de la cabina es expulsado fuera de la sala después de la etapa de filtración. En las cabinas que trabajan a presión negativa respecto de la sala, la presión en la cámara suele ser ligeramente inferior a la de las cajas de transferencia o paso.
Ver figura 2, "Aisladores de laboratorio".
Las Cabinas de Seguridad Biológica (CSB) clase III de acuerdo a la norma UNE-EN 12469:2001 están diseñadas para el manejo de los agentes microbiológicos más peligrosos y clasificadas como de nivel de bioseguridad 4. Trabajan a presión negativa. Debido a la total contención del producto, también se pueden utilizar para la manipulación de citostáticos.
Estas cabinas disponen de caja de transferencia para introducir y sacar los productos y puertos de acceso con guantes. Incorporan filtros absolutos de muy alta eficacia grupo H (HEPA) generalmente de clase H14, o filtros de ultra baja penetración grupo U (ULPA) situados en la entrada y en la extracción del aire. En la extracción generalmente se colocan dos filtros en serie.
Algunos modelos añaden prefiltros clase G3 según norma UNE-EN 779: 2013.
También existen CSB clase III con flujo laminar tanto en la cámara de trabajo como en la caja de transferencia o paso de material.
Ver figura 3, "Cabina de Seguridad Biológica (CSB) clase III".
Cabinas de seguridad específicas para citostáticos. Existen cabinas de seguridad que se comercializan como específicas para citostáticos; suelen ser habitualmente CSB clase II según la norma UNE-EN 12469:2001 (ya citada) con flujo laminar vertical en la zona de trabajo y extracción total. Además incorporan triple filtración, con el tercer filtro debajo de la zona de trabajo. Son filtros absolutos de muy alta eficacia grupo H (HEPA) generalmente clase H14, o bien filtros de ultra baja penetración grupo U (ULPA). Algunas de estas cabinas permiten el cambio de los filtros contaminados y la esterilización de las zonas contaminadas sin afectar a la seguridad de los usuarios y del entorno.
La norma alemana DIN 12980:2006 contiene requisitos específicos para cabinas de seguridad destinadas a la manipulación de sustancias citotóxicas.
La cabina para preparación de citostáticos debe ser de uso exclusivo para este fin. Además se debe tener en cuenta que dependiendo de la cabina por la que se opte, los requerimientos ambientales y de protección individual variarán pero, en todos los casos, la expulsión del aire debe ser siempre al exterior, bien a través de un conducto rígido de forma directa o por el sistema general del edificio.
Ver figura 4, "Cabina de seguridad específicas para citostáticos".
Local o área de preparación específico
El emplazamiento de la/as cabina/as en el local deberá ser tal que no se produzcan turbulencias de aire en el frente de las mismas, por lo que se evitará su localización en zonas de paso de personal, de influencia de sistemas de renovación-acondicionamiento de aire o próximas a puertas y/o ventanas.
Dependiendo del tipo de cabinas, los requerimientos ambientales pueden ser más o menos rigurosos. Las CSB clase III y los aisladores pueden estar ubicados en zonas con menores exigencias ambientales que las CSB de clase II para citostáticos. Cuando se utilicen estas últimas, es recomendable que el área de preparación de medicamentos citostáticos reúna una serie de características como son:
- Área aislada físicamente del resto, dedicada exclusivamente a este tipo de trabajo.
- Acceso restringido al personal autorizado, con señalización adecuada.
- Señalización sobre el uso de los equipos de protección individual (EPI) necesarios.
- Constará de, al menos, dos zonas bien diferenciadas conectadas entre sí por una zona de paso:
- Una antesala, destinada al almacenamiento y acondicionamiento del material.
- Una zona de paso, de transferencia de materiales y personas, que actúa de barrera frente a la contaminación (esclusa). En esta zona, el personal se colocará los EPI cuando vaya a entrar en la zona de preparación y los retirará cuando circule hacia la antesala. Es aconsejable la instalación de mecanismos que impidan la apertura simultánea de las dos puertas de la zona de paso.
- Zona de preparación propiamente dicha. En ella se ubicarán la/las cabina/as. Es recomendable que sea una sala sin recirculación de aire, ni existencia de aire acondicionado ambiental y preferiblemente, con sobrepresión negativa.
- Es recomendable que la zona de paso y de preparación tengan consideración de zonas limpias para lo cual deben cumplir, entre otros, los requisitos que se indican a continuación. Los niveles de limpieza del aire, presión diferencial, temperatura y humedad relativa deben mantenerse dentro de unos límites concretos. Los cerramientos y la climatización deben estar diseñados para no generar partículas de polvo y el personal que interviene ser adiestrado en este sentido. En el ambiente se deben controlar las partículas existentes y la contaminación microbiológica mediante sistemas de tratamiento del aire que hacen circular el aire por circuitos independientes y lo filtran a través de filtros HEPA. La circulación del aire será de la zona de mayor exigencia de limpieza a la zona de menor exigencia y para ello será necesaria una diferencia de presión de 10 Pa entre salas de diferente clasificación con las puertas cerradas. Las paredes, suelos, techos y superficies de trabajo estarán fabricados con materiales lisos, no porosos y provistos de un revestimiento que facilite su lavado (pintura plástica, resina epoxi).
- Se realizará una descontaminación periódica del aire, de manera que se optimice el tratamiento del aire y la limpieza.
- El suelo del recinto donde se encuentran ubicadas las cabinas no se debe barrer. Es recomendable que la limpieza se realice mediante métodos húmedos con productos de limpieza especificados en el correspondiente procedimiento, empleando utensilios exclusivos para este fin.
- Se recomienda la instalación de una fuente lavaojos próxima a la zona de manipulación, con suministro de agua, preferentemente templada, para el lavado inmediato de los ojos y la piel en caso de salpicaduras o proyecciones, o bien unidades de lavado de ojos y duchas con soluciones de lavado polivalentes. Su número y distribución dependerá de las dimensiones y características del laboratorio.
Utilización de dispositivos y técnicas para la preparación de citostáticos
Por ejemplo dispositivos cerrados, estancos, que se colocan en la cabina y cuyo objetivo es el confinamiento del citostático, sistemas de liberación de presiones (agujas de venteo y los sistemas aguja-filtro-válvula) y técnicas como la de presión negativa de Wilson y Solimando que evitan la formación de aerosoles.
Medidas sobre la organización y el método de trabajo
Se recomienda:
- la redución al mínimo del número de personas que trabajen con citostáticos,
- la confección de un registro de los citostáticos utilizados,
- la elaboración y establecimiento de procedimientos para la preparación teniendo en cuenta las instrucciones del suministrador y la forma farmacéutica con la que se presenta el citostático,
- el control estricto del seguimiento de los procedimientos por parte de los manipuladores,
- la adquisición de los citostáticos teniendo en cuenta aspectos como:
- la adaptación de las presentaciones comerciales a las dosis y concentraciones habituales,
- diseño que contribuya a minimizar la contaminación exterior,
- la elección de viales frente a ampollas, en los que el sellado tras la punción es más eficiente,
- la elección de soluciones para uso inmediato frente a liofilizados,
- la elección de envases de polipropileno frente a los de cristal.
- la designación de una persona que se responsabilice de los aspectos mencionados.
Trabajo en cabinas
Como ya se ha indicado, para la preparación de citostáticos se debe seguir rigurosamente el protocolo establecido para cada tipo de cabina utilizado. Algunas recomendaciones generales para una manipulación adecuada son:
1. Normas generales de trabajo
- Los trabajadores que manipulen los citostáticos deben conocer las características e instrucciones de uso de las cabinas previamente a su utilización.
- Los manipuladores deben lavarse las manos con jabón germicida antes de la colocación de los guantes.
- Este tipo de cabinas suelen estar diseñadas para funcionar permanentemente. En caso de desconexión, se debe esperar el tiempo necesario para que se estabilice el flujo laminar. Este tiempo debe estar indicado en el procedimiento, habitualmente es en torno a 20 minutos.
- Se adoptarán las normas de higiene habitualmente establecidas en áreas de trabajo estériles (ausencia de joyas, prohibición de comer, beber, evitar el uso de cosméticos, etc).
- Se colocará en la superficie de trabajo de la cabina (siempre que no sea perforada) un paño estéril, absorbente por la parte superior y plastificado por la inferior para recoger los posibles vertidos accidentales que pudieran producirse. El paño se sustituirá después de cada ciclo de trabajo o cuando se produzca un derrame.
- No se debe bloquear la entrada o salida de aire con papel u objetos.
- No deben colocarse objetos en la parte superior de la cabina.
- Solo se introducirá en la cabina el material necesario para la manipulación y preparación de citostáticos. Los contenedores, envases, etc. se limpiarán previamente con una solución antiséptica, por ejemplo etanol al 70%. Se evitarán objetos como calculadoras, cuadernos de notas, etc.
- Los productos a manipular se colocarán dejando una distancia entre ellos con objeto de mantener el flujo de aire y nunca a menos de 8 cm de los lados y 10 cm del frente de la cabina. Es recomendable que los productos estériles se coloquen en el centro de la cabina y los no estériles en la parte más externa.
- Una vez que todo el material necesario esté dentro de la cabina, es conveniente esperar de 2 a 3 minutos antes de comenzar a trabajar, para que se restablezcan las condiciones de flujo.
2. Manipulación de ampollas y viales
Si el citostático se presenta en ampolla, antes de abrirla se debe comprobar que no hay producto en el cuello de la ampolla. Para evitar cortes y salpicaduras al abrirla, se ha de colocar una gasa estéril impregnada en etanol al 70% alrededor del cuello de la ampolla y abrirla en dirección contraria al manipulador. Se extraerá todo el contenido, se ajustará la dosis e introducirá el sobrante en un vial vacío para su retirada como residuo.
Si el citostático se presenta en un vial, se recomienda la limpieza del tapón con etanol al 70%. Para evitar la sobrepresión en el interior y la formación de aerosoles, es recomendable la utilización de filtros de venteo provistos de membrana hidrófoba de 0,22 micrómetros. Durante la reconstitución del fármaco, únicamente se debería perforar el tapón del vial una vez y utilizar la misma aguja para todo el proceso, sin extraerla del vial.
En todos los casos es recomendable el uso de jeringas con conexiones tipo Luer que aseguran una unión firme de la aguja y evitan fugas.
Es conveniente que las jeringas sean de dimensiones suficientes para que no sea necesario llenarlas más de tres cuartos de su capacidad.
3. Normas de limpieza
Es importante que se utilicen los EPI fijados en el procedimiento para esta tarea específica.
Durante las operaciones de limpieza, el ventilador de la cabina debe estar funcionando y se tendrá especial cuidado en que el filtro no se moje.
No se debe verter agua ni otros líquidos directamente en la zona de trabajo, se utilizarán paños ligeramente humedecidos de tejidos estériles de un solo uso, que no desprendan partículas ni fibras. Primeramente es conveniente que se efectúe una limpieza con agua jabonosa y seguidamente que se aplique un desinfectante. Se puede realizar el arrastre utilizando una gasa estéril, siguiendo el sentido del flujo del aire de la cabina desde las áreas de menor a mayor contaminación, primeramente las paredes laterales de arriba hacia abajo y posteriormente la superficie de trabajo desde el fondo al exterior.
La limpieza y desinfección se debe realizar en los siguientes casos:
- antes de comenzar cualquier trabajo, una vez finalizado éste y siempre que cambie el programa de trabajo,
- en caso de producirse derrames, y
- antes de realizar pruebas de control mecánicas o biológicas.
Todo el material utilizado en la limpieza se debe tratar como residuo contaminado.
4. Mantenimiento
El plan de mantenimiento de las cabinas debería incluir las verificaciones a realizar así como su frecuencia.
Para elaborar el plan deben tenerse en cuenta las instrucciones del fabricante y la organización de trabajo. En cualquier caso, es una recomendación general el cambio diario de mangas y guantes de los aisladores y CSB clase III.
5. Retirada de residuos
Se considera como residuo citostático a todo el material utilizado en las distintas fases de manipulación de estos fármacos. Incluye restos del propio fármaco, soluciones preparadas y no administradas, citostáticos caducados, y todo el material que ha estado en contacto con los citostáticos durante su preparación y administración como son los envases, jeringas, paños, guantes etc.
Todo el material usado con los medicamentos citostáticos debería ser desechable y retirarse y eliminarse según los procedimientos establecidos para la gestión de residuos. El procedimiento para la gestión de residuos debe tener en cuenta las normativas autonómicas y locales.
Los residuos deben desecharse en contenedores resistentes, rígidos e impermeables, convenientemente cerrados e identificados con el pictograma correspondiente. Es conveniente que los contenedores se sitúen lo más cerca posible de las áreas de trabajo y que no se llenen más de tres cuartos de su capacidad. Una vez llenos se procede a su retirada de acuerdo con el Plan de Gestión de Residuos Sanitarios. En ningún caso se deben verter o eliminar de forma incontrolada.
Se recomienda disponer de un registro de residuos peligrosos.
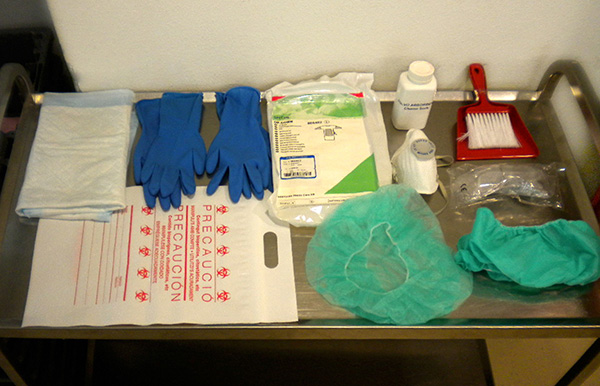
Ver figura 5, "Kit de recogida de residuos".
Medidas de higiene personal
- Prohibición de comer, beber, masticar chicle o almacenar alimentos en las zonas de trabajo.
- El personal no utilizará maquillaje ni otros productos cosméticos que puedan provocar una exposición prolongada en caso de contaminación. Tampoco es recomendable el uso de lentes de contacto ni de joyas.
- Los trabajadores deben disponer para su aseo personal, dentro de la jornada laboral, de al menos diez minutos antes de la comida y otros diez minutos antes de abandonar el trabajo.
- El empresario se responsabilizará del lavado y descontaminación de la ropa de trabajo, quedando prohibido que los trabajadores se lleven dicha ropa a su domicilio para tal fin.
- Los trabajadores dispondrán de:
- lugares en los que se pueda guardar, de manera separada, la ropa de trabajo o de protección y la de vestir (por ejemplo taquillas o armarios),
- retretes y cuartos de aseo apropiados, duchas, lavamanos con jabón germicida y crema hidratante para las manos.
- un lugar para el almacenamiento de los EPI.
Registro de personal expuesto
Se debe elaborar un registro del personal profesional expuesto a agentes citotóxicos para realizar una vigilancia específica de la salud.
MEDIDAS DE PROTECCIÓN INDIVIDUAL DEL TRABAJADOR
Utilización de equipos de protección individual
El empresario debe proporcionar a los trabajadores los EPI adecuados a su tarea. Estos deben disponer de marcado CE con los pictogramas que indiquen la protección ofrecida y el folleto informativo al menos en castellano. El trabajador debe utilizar los EPI según lo indicado en los procedimientos de trabajo establecidos.
El mal uso de los EPI puede ocasionar un daño grave a la salud de los trabajadores, por lo que el empresario se asegurará de que éstos reciban una información y adiestramiento suficientes sobre su utilización correcta, con especial atención a su ajuste, así como sobre la limpieza, conservación, almacenamiento y necesidad de sustitución. A estos efectos, entre otras fuentes, se tendrán en cuenta las instrucciones del fabricante. Deben estar certificados como producto sanitario y como equipo de protección individual.
Los EPI preceptivos para esta situación de trabajo dependen de la cabina en la que se realicen las preparaciones y de las condiciones del local en el que estén ubicadas. En aquellos casos en los que sea necesario utilizar conjuntamente guantes, bata de protección, mascarilla, gorro y cubre zapatos o calzas, el orden de colocación y retirada es importante. En primer lugar se colocará el gorro y los cubre zapatos o calzas. Después de limpiarse la manos con una solución hidroalcohólica se colocará la mascarilla y a continuación el primer par de guantes seguido de la bata con los puños por encima de los guantes. Por último, en su caso, el segundo par de guantes sobre el puño de la bata.
Protección de las manos: guantes de protección frente a productos químicos
No existe un tipo de guante que sea impermeable a todos los citostáticos. La permeabilidad depende del material del guante y el grosor, del tipo de medicamento y del tiempo de contacto.
Se consideran adecuados los guantes esterilizados de un solo uso (o desechables) de materiales como policloropreno, nitrilo y látex (preferiblemente de menos de 30 mg/g de proteínas para evitar alergias). No son adecuados los de cloruro de polivinilo por su mayor permeabilidad a ciertos preparados y los guantes con talco.
La periodicidad con que se deben cambiar los guantes depende de las condiciones de trabajo concretas, pero el cambio será inmediato cuando se contaminen, se rompan y al finalizar la sesión o ciclo.
Los guantes se colocan sobre las manos limpias y después de usarlos se lavarán y secarán las manos. Se evitará su contacto con áreas susceptibles de ser contaminadas y en particular con la cara.
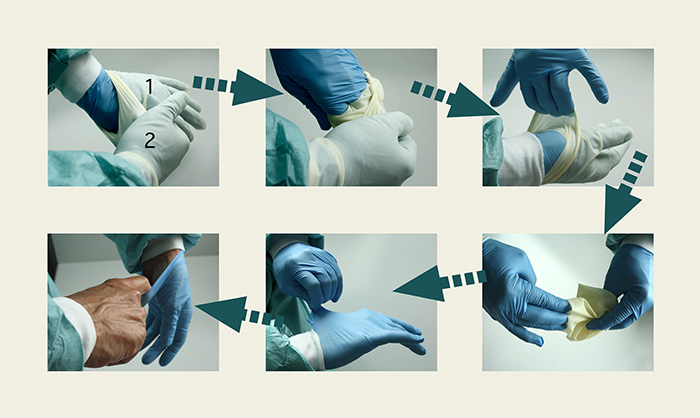
Es habitual el uso de dos pares de guantes, por ejemplo de nitrilo y látex, para aumentar la protección. En estos casos, se pondrá primero un guante por debajo de la manga de la bata y por encima de ésta, el otro guante. Especialmente recomendable es el empleo de doble guante o guantes de doble grosor (aproximadamente 0,45 mm en los dedos y 0,27 mm en la palma de la mano) para la limpieza de superficies, materiales o envases y cuando exista riesgo de exposición por derrames. La secuencia de retirada de los dos pares de guantes será:
- Par exterior de guantes (sobre el puño de la bata)
Se sujeta el guante exterior de la mano 1 con la mano 2 y se tira de él tocando sólo la parte exterior del guante de la mano 1, con el fin de evitar la contaminación del par interior.
Con la mano que únicamente tiene un guante, se saca el guante de la mano 2, sin tocar el exterior del guante.
- Par interior de guantes (bajo el puño de la bata)
Se tira de la parte superior de ambos guantes para liberarlos del puño de la bata tocando sólo la parte exterior del guante. A continuación, con la mano enguantada 1, se retira el guante de la mano 2 sujetándolo desde el exterior. Con la mano 2 desnuda, se introducen los dedos por la parte interior del guante restante y se desecha.
Figura 6, "Secuencia de retirada de los guantes", imagen más abajo.
Protección de las vías respiratorias
En general, si se trabaja en una cabina de seguridad para citostáticos, adecuada y debidamente mantenida, no es necesaria la utilización de protección respiratoria. El empleo de equipos de protección respiratoria puede estar indicado en las siguientes situaciones:
- En las operaciones de limpieza del interior de la cabina de seguridad.
- En operaciones puntuales o excepcionales como por ejemplo retirada de material, cambio de filtros o en el caso de derrames en el exterior de la cabina.
Los equipos de protección respiratoria deben ser equipos filtrantes tipo mascarillas autofiltrantes FFP3 contra partículas o adaptadores faciales tipo máscaras o medias máscaras con filtro P3.
Protección de los ojos y cara: gafas/pantallas de protección
La utilización de protección facial u ocular no es necesaria cuando se trabaja en cabinas adecuadas.
Puede ser adecuada en operaciones de limpieza de la cabina y cuando se produzcan derrames fuera de ella.
En esos casos, puede ser preferible el uso de pantalla de protección facial al uso de protección ocular. El marcado de la pantalla incluirá el campo de uso 3 (salpicadura de líquidos). Si se utilizan gafas, son recomendables las panorámicas de protección lateral con campo de uso 3 (protección frente a gotas).
Si estos equipos no son desechables, se tendrá especial cuidado en su limpieza y descontaminación con detergente y agua después de su uso.
Protección del cuerpo: bata de protección
La bata será desechable, con abertura trasera, de baja permeabilidad, reforzada en la parte delantera, con mangas largas y puños elásticos ajustados. Tendría consideración de traje de protección parcial del cuerpo frente a salpicaduras de líquido Tipo 6 [PB].
El personal deberá quitarse la bata y depositarla en el lugar indicado antes de abandonar el área de trabajo.
La frecuencia del cambio de bata estará establecida en el procedimiento de trabajo. Una recomendación general es que se deseche al final de la tarea y siempre que se produzcan derrames o roturas.
Ropa de trabajo
Además de los EPI, es un requisito de las “salas limpias” la utilización de gorro y calzas o calzado específico. En el caso de que se utilice calzado específico, debe ser lavable y esterilizable y se establecerá una sistemática de limpieza periódica.
Si se produce una contaminación de la ropa por una exposición accidental se deberá retirar inmediatamente, incluso si no ha habido contacto con la piel, se lavarán las manos y se sustituirá por ropa limpia.
Protección de personas especialmente sensibles
Dada la clasificación de los citostáticos como potencialmente cancerígenos, mutágenos o tóxicos para la reproducción, no deben trabajar como manipuladores de citostáticos aquellas personas que:
- Sufren alergia a los citostáticos y/o patologías dermatológicas importantes.
- Tienen historia de abortos, están en edad fértil y tienen voluntad de reproducción.
- Trabajan con radiaciones ionizantes.
- Han recibido tratamientos citostáticos o inmunosupresores.
- Presentan disminución o ausencia de respuesta inmunitaria.
- Se sospecha tienen daño genético o bien que determinados parámetros biológicos lo desaconsejan.
Estarán excluidos de forma temporal de la manipulación de citostáticos:
- Las embarazadas y madres lactantes.
- Los trabajadores y las trabajadoras que planeen un embarazo a corto plazo.
- Los que hayan sufrido un accidente con citostáticos y estén en estudio.
- Los trabajadores con patologías transitorias susceptibles de empeorar en contacto con estos fármacos.
Evaluación de la exposición
Una vez implementadas las medidas preventivas de control técnico y organizativo se debe realizar una evaluación de la exposición a los agentes citostáticos. La evaluación de la exposición y su seguimiento son de utilidad para comprobar la efectividad de las medidas preventivas y deberían utilizarse con este fin.
La evaluación de la exposición se realiza teniendo en cuenta los agentes químicos, las condiciones de utilización y las medidas de prevención así como la actividad desarrollada por cada trabajador. En el caso de que haya trabajadores especialmente sensibles o trabajadoras embarazadas, que hayan dado a luz recientemente o en periodo de lactancia natural, se tendrán en cuenta sus especiales condiciones en la realización de la evaluación. Para éstas últimas, se deben seguir las disposiciones del Real Decreto 298/2009 y tener en cuenta las recomendaciones del documento “Directrices para la Evaluación de Riesgos y Protección de la Maternidad en el trabajo” del Instituto Nacional de Seguridad e Higiene en el Trabajo.
La exposición se evaluará teniendo en cuenta las vías de entrada inhalatoria y dérmica. En esta situación de trabajo la contaminación de superficies es un factor de riesgo crítico, por lo que es recomendable considerar muy especialmente la contaminación de superficies en el proceso de evaluación.
Los citostáticos son, en general, compuestos altamente tóxicos y algunos de ellos cancerígenos y mutágenos por lo que la evaluación y seguimiento de la exposición debería llevarse a cabo, siempre que sea técnicamente posible, mediante mediciones. Como normalmente se utiliza una gran variedad de agentes citostáticos y son muy pocos los métodos de medición disponibles, la evaluación de la exposición de los trabajadores puede llevarse a cabo seleccionando uno o más de los citostáticos que se utilicen más frecuentemente entre los que se disponga de método de medición.
Las mediciones en aire pueden ser necesarias para la confirmación de la adecuación de las medidas preventivas o si se considera que puede existir riesgo de inhalación, por ejemplo por funcionamiento deficiente de las cabinas de seguridad. En algún caso existen métodos validados, como por ejemplo para compuestos de platino soluble. Como alternativa a medir directamente el citostático, se podría utilizar como indicador o trazador una sustancia de características conocidas y comportamiento físico asimilable al citostático. En el caso de que la realización de mediciones sea factible, se llevarían a cabo siguiendo las recomendaciones de la Guía Técnica del Instituto Nacional de Seguridad e Higiene en el Trabajo para la evaluación y prevención de los riesgos presentes en los lugares de trabajo relacionados con agentes químicos, en especial los apéndices 4, 5 y 6 sobre métodos de medición y estrategia de medición.
El muestreo de superficies puede proporcionar información sobre los niveles de contaminación de la superficie de trabajo y la adecuación de los procedimientos de limpieza y puede ser útil después de la descontaminación en el caso de derrames importantes. Las mediciones de contaminación de superficies pueden utilizarse para estimar la exposición dérmica. Existen métodos de medición en superficies para algunos citostáticos como para ciclofosfamida, fluorouracilo (5FU), ifosfamida (IFO) o metotrexato.
Aunque en la práctica no existen valores límite para comparar los resultados de las mediciones, su realización y la observación de la tendencia de los datos puede ser útil para demostrar que las medidas de control son o se mantienen adecuadas, o bien que es necesaria su revisión. Estas mediciones también pueden ser útiles para confirmar el restablecimiento del control adecuado si se produce un fallo de las medidas de control implementadas.
Una vez que la exposición esté suficientemente controlada, se efectuará un seguimiento de la exposición para asegurar que se mantiene la adecuada prevención y protección. El seguimiento de la exposición puede llevarse a cabo mediante cualquier prueba o medición periódica que ayude a confirmar la eficacia de las medidas de control establecidas.
Considerando el potencial cancerígeno, mutágenico y tóxico para la reproducción de los citostáticos y que la exposición potencial dependerá del conjunto de medidas preventivas implementadas en cada caso concreto, el seguimiento se debe llevar a cabo valorando la adecuación del sistema preventivo de la empresa, es decir si las instalaciones son correctas y se realiza un mantenimiento periódico, si los EPI son los adecuados y se utilizan adecuadamente, si se siguen rigurosamente los procedimientos o normas de trabajo establecidos y si se lleva un registro completo de las actuaciones que se realizan de forma que permitan extraer conclusiones válidas respecto del mantenimiento de la adecuada prevención y protección. En su caso, esto puede ser complementado por el muestreo de superficies a intervalos adecuados y después de las tareas de descontaminación en el caso de derrames importantes.
Formación e información
El personal encargado de la preparación de citostáticos deberá ser cualificado, con conocimiento de los riesgos de la manipulación incorrecta de estos medicamentos, así como de las condiciones que se exigen para cada forma farmacéutica.
El empresario garantizará:
- Que cada trabajador que se incorpora al puesto con potencial riesgo de exposición a citostáticos reciba una formación teórica y el entrenamiento adecuado hasta obtener una garantía de manejo seguro de dichos medicamentos en las cabinas de seguridad destinadas a tal fin.
- Que los trabajadores expuestos reciban formación suficiente y adecuada e información precisa basada en todos los datos disponibles, en particular en forma de instrucciones de trabajo o protocolos de actuación, en relación con:
- Los riesgos potenciales para la salud, incluidos los riesgos adicionales debidos al consumo de tabaco y a los posibles efectos sobre el feto, haciendo hincapié en la importancia de una notificación inmediata ante cualquier sospecha de embarazo en una trabajadora.
- Las precauciones que se deberán tomar para prevenir la exposición.
- Las disposiciones en materia de higiene personal.
- La utilización, selección y empleo de EPI, su almacenamiento, limpieza y mantenimiento.
- Las medidas que deberán adoptar los trabajadores, en particular el personal de intervención, en caso de incidentes y para su prevención.
- Las instalaciones donde se manipulen agentes citostáticos.
- La gestión de los residuos, así como procedimientos ante eventuales accidentes, derrames, vertidos o rotura de envases.
- La comunicación de cualquier deficiencia detectada por los trabajadores, así como las sugerencias de mejora.
- Las medidas de actuación frente a emergencias y para solicitar ayuda (Tel. de emergencias: 112; Tel. del Instituto Nacional de Toxicología: 91 56 20 420).
- Que los trabajadores tendrán acceso a la información contenida en la documentación relativa a evaluaciones de riesgos, las medidas preventivas implantadas, la eficacia de las mismas, las conclusiones de las mediciones realizadas, historiales, etc., cuando dicha información les concierna a ellos mismos.
- Que los representantes de los trabajadores o los propios trabajadores tendrán acceso a cualquier información sobre las causas que hayan dado lugar a las exposiciones accidentales y a las exposiciones no regulares así como de las medidas adoptadas o que se deban adoptar para solucionar la situación.
- Las fichas técnicas de medicamentos, así como las fichas de datos de seguridad de otros agentes químicos utilizados. Se recomienda recopilar, conservar y mantener actualizadas estas fichas. Esta información será transmitida de forma que sea comprensible por cuantos trabajan con estos productos.
Vigilancia de la salud
El empresario está obligado a garantizar la vigilancia periódica de la salud de los trabajadores y a mantener actualizado un registro del personal expuesto que se pondrá en conocimiento del servicio de vigilancia de la salud para que pueda realizar la vigilancia específica.
La vigilancia de la salud de los trabajadores que manipulen o entren en contacto con agentes citostáticos se debe realizar con carácter obligatorio antes del inicio de los trabajos, periódicamente, tras una exposición accidental aguda, tras ausencia prolongada del trabajo y en el momento de dejar el trabajo de manipulación (por cese, jubilación o cambio de puesto). Para este fin se dispone de las pautas establecidas en el Protocolo de Vigilancia Sanitaria Específica para los trabajadores expuestos a Agentes Citostáticos publicado por el Ministerio de Sanidad, Servicios Sociales e Igualdad.
Para que el programa de vigilancia de la salud se ajuste a los riesgos de los trabajadores, el empresario debe facilitar a la unidad médica encargada de la vigilancia de la salud información de los riesgos derivados de los agentes químicos presentes en el lugar de trabajo.
Fuentes de información
Nota. En este anexo se relacionan únicamente las fuentes de información específicas relativas a la situación de trabajo descrita. No se incluyen referencias a la normativa sobre prevención de riesgos laborales aplicable a los agentes químicos ni a otros documentos de aplicación general cuyas referencias se encuentran listadas y accesibles en “Enlaces de interés”.
Legislación
- Real Decreto 1591/2009, de 16 de octubre, por el que se regulan los productos sanitarios.
- Real Decreto 1345/2007, de 11 de octubre por el que se regula el procedimiento de autorización, registro y condiciones de dispensación de los medicamentos de uso humano fabricados industrialmente.
Nomas Técnicas
- UNE-EN 12469:2001. Biotecnología. Criterios de funcionamiento para las cabinas de seguridad microbiológica.
- UNE-EN 779:2013. Filtros de aire utilizados en ventilación general para eliminación de partículas. Determinación de las prestaciones de los filtros.
- UNE-EN 1822-1:2010. Filtros absolutos (EPA, HEPA y ULPA). Parte 1: Clasificación, principios generales del ensayo y marcado.
- DIN 12980:2006. Laboratory furniture. Safety Cabinets for Handling Cytotoxic Substances
Publicaciones
- ASSTSAS. Safe Handling of Hazardous Drugs. Prevention Guide 2008.
- NIOSH. Alert Preventing Occupational Exposures to Antineoplastic and other Hazardous Drugs in Healthcare Settings, 2004.
- HSE. Safe handling of cytotoxic drugs
- Xavier Guardino Solá, Mª Gracia Rosell Farrás y Míriam Galisteo Manzanares. NTP nº 740. Exposición laboral a citostáticos en el ámbito sanitario. INSHT, 2007.
- Torrado del Rey S, RosellFarrás MG, Guardino Solá X. Exposición a citostáticos en centros sanitarios. Determinación de ciclofosfamina en superficies de trabajo y en el exterior de viales. Rev. Sociedad Española de Medicina y Seguridad del Trabajo (SEMST). 2009, vol. 4, nº 3, p.121-130.
- J. Maria Hedmer, Bo A. G. Jonsson and Olle Nygrenb. Development and validation of methods for environmental monitoring of cyclophosphamide in workplaces. J. Environm. Monit., 2004, 6, 979-984.
Sitios web
- Agencia Española de Medicamentos y Productos Sanitarios (AEMPS). Consultado el 8 de octubre de 2019, en https://www.aemps.gob.es
- Drug Distribution and Control: Preparation and Handling–Guidelines. Concultado el 8 de octubre de 2019, en https://www.ashp.org/pharmacy-practice/policy-positions-and-guidelines/browse-by-topic/drug-distribution-and-control
Descarga
| Descarga pdf | Tamaño |
|---|---|
|
|
(PDF
, 3,8 MB)
|
Anexo 1. Tareas en la manipulación de citostáticos en un Servicio de Farmacia Hospitalaria
Los agentes citostáticos son sustancias capaces de inhibir o impedir la evolución de las neoplasias, restringiendo la maduración y proliferación de células malignas, que se utilizan de forma preferente, aunque no exclusivamente como tratamiento oncológico; este mecanismo, hace que, a su vez, sean por sí mismas carcinógenas, mutágenas y/o teratógenas.
La manipulación de citostáticos comprende todas las operaciones necesarias para la preparación de las dosis de los medicamentos citostáticos, desde la recepción, transporte y almacenamiento, hasta la administración a los pacientes, eliminación de residuos y el mantenimiento de las cabinas.
En el servicio de farmacia las principales tareas serían:
1. Recepción y almacenamiento
La recepción se debe realizar en sitio único y controlado por personal con conocimiento de los productos que maneja. Los fabricantes deben garantizar que el envío se realiza en las mejores condiciones para evitar contaminaciones y accidentes.
El lugar de almacenamiento debe ser adecuado para evitar posibles caídas y roturas de envases. Sería conveniente su almacenamiento en una zona independiente del resto de fármacos.
2. Preparación
Es el proceso de preparación de medicamentos citostáticos en los servicios de farmacia de hospitales, en el que, a partir del producto que se recibe del laboratorio fabricante, se obtienen dosis de citostáticos en unas condiciones adecuadas para su posterior administración a los pacientes. La preparación de agentes citostáticos debe realizarse en cabina de seguridad.
Es en este proceso, si no se toman las medidas preventivas adecuadas, donde puede existir un mayor riesgo de exposición a estos productos.
3. Transporte interno
Es necesario transportar los citostáticos desde la zona donde se preparan las dosis de citostáticos hasta la zona de administración de los mismos. Cuanto menor sea el recorrido de los preparados, menores son los riesgos de errores y de incidentes.
Se debe realizar de forma que se eviten roturas o derrames. El personal encargado debe conocer las medidas a llevar a cabo en caso de que se produzca un accidente.
Los contenedores que alberguen estos productos para su transporte deben cumplir las siguientes características:
- Resistencia al transporte.
- Contener exclusivamente el citostático.
- Etiquetado adecuado. En el exterior del paquete se debe hacer constar la naturaleza del contenido y paciente destinatario.
- Aislante térmico para el necesario mantenimiento de la temperatura.
4. Tratamiento de derrames
Los derrames accidentales se pueden producir en cualquier proceso en que esté presente un medicamento citostático (almacenamiento, preparación, transporte y/o administración), por lo que deberán estar previstos los procedimientos y materiales necesarios para realizar la recogida.
Estos derrames deben ser limpiados inmediatamente por personal formado para ello y debidamente informado de la protección que debe usar y de los procedimientos de trabajo. El contenido orientativo de un kit de derrames es: dos pares de guantes de materiales como policloropreno, nitrilo o látex de resistencia mecánica adecuada; bata desechable de baja permeabilidad; pantalla facial o gafas de seguridad; mascarilla de protección respiratoria FFP3; calzas; gorro; material absorbente (que sea incinerable); bolsas para residuos citostáticos; manoplas; paleta y escobilla desechables para recoger los fragmentos de vidrio y contenedor de objetos cortantes.
5. Eliminación de los residuos
Para la eliminación de los residuos citostáticos se requieren contenedores rígidos específicos y con cierre hermético. Deben estar perfectamente identificados. Se procederá de la manera siguiente:
- Los contenedores no se deben situar en lugares de paso dentro de las unidades y se retirarán con una periodicidad establecida en el Plan de Gestión de Residuos Sanitarios.
- El almacenamiento final se hará de forma independiente del resto de residuos, en lugar ventilado y a ser posible refrigerado.
- Durante todo el proceso de recogida y traslado de las bolsas y contenedores, es necesario que se asegure el mínimo contacto del personal con el contenido de estos recipientes.
- La eliminación de estos residuos se realizará mediante la recogida de los mismos por una empresa autorizada para ello y su posterior tratamiento por incineración.
6. Limpieza y mantenimiento de la cabina de seguridad
La frecuencia de la limpieza será variable puesto que depende del tipo de cabina y su uso.
La sustitución periódica de los filtros la realiza generalmente el personal encargado del mantenimiento de las cabinas y es un punto crítico en la potencial exposición. La exposición a citostáticos en esta tarea se debe a los productos retenidos en los filtros. Esta tarea debe estar perfectamente programada y realizada con las máximas garantías de seguridad. Se deben extremar las precauciones en aquellas cabinas que requieren descontaminación previa por no contar con un diseño específico para el cambio de filtros que garantice la seguridad del operario.
Anexo 2. Principales compuestos citostáticos y productos relacionados
Los medicamentos de uso humano están regulados por una normativa específica, quedan fuera del ámbito de aplicación del Reglamento (CE) nº 1272/2008 sobre clasificación, etiquetado y envasado de sustancias y mezclas, por lo que en la tabla no se recogen datos como la clase de peligro, la categoría o la indicación de peligro.
La tabla incluye el listado de compuestos citostáticos y relacionados extraído de la NTP 740 a la que se han incorporado valores límite de la base de datos GESTIS y en la última columna, el análisis preclínico sobre seguridad obtenido de las fichas técnicas de medicamentos.
| Agente químico | Nº CAS | Modo de acción | Clasificación IARC(1) | Valor Límite | Análisis Preclínico sobre seguridad |
|---|---|---|---|---|---|
| ACTINOMICINA | 50-76-0 | ANTIBIÓTICO | 3 | Altamente tóxico | |
| ADRIAMICINA | 25316-40-9 | ANTIBIÓTICO | 2A | ||
| ALDESLEUKINA | 110942-02-4 | INMUNOSUPRESOR | |||
| ALEMTUZUMAB | 216503-57-0 | ANTICUERPO MONOCLONAL | |||
| ALTRETAMINA | 645-05-6 | INHIBIDOR CRECIMIENTO CELULAR | |||
| AMINOGLUTETIMIDA | 125-84-8 | INHIBIDOR DE AROMATASA | |||
| AMSACRINA | 51264-14-3 | INHIBIDOR DE LA TOPOSIOMERASA | 2B | ||
| ANASTROZOL | 120511-73-1 | INHIBIDOR DE AROMATASA | |||
| ASPARAGINASA | 9015-68-3 | INHIBIDOR DE ASPARAGINASA | |||
| AZACITIDINA | 320-67-2 | ANTIMETABOLITO | 2A | Citotóxico | |
| AZASERINA | 115-02-6 | ANTIMETABOLITO | 2B | ||
| AZATIOPRINA | 446-86-6 | INMUNOSUPRESOR | 1 | 0,05 mg/m3 (Países Bajos) | Teratogenicidad en animales |
| BEVACIZUMAB | 216974-75-3 | ANTICUERPO MONOCLONAL | |||
| BEXAROTENO | 153559-49-0 | INHIBIDOR CRECIMIENTO CELULAR | |||
| BICALUTAMIDA | 90357-06-5 | ANTIANDRÓGENO | |||
| BLEOMICINA | 11056-06-7 | ANTIBIÓTICO | 2B | ||
| BLEOMICINA HCl | 61163-87-5 | ANTIBIÓTICO | 2B | ||
| BLEOMICINA SULFATO | 9041-93-4 | ANTIBIÓTICO | 2B | ||
| BORTEZOMIB | 179324-69-7 | INHIBIDOR DEL PROTEASOMA | Posible efecto potencial en fertilidad masculina o femenina | ||
| BUSERELINA | 57982-77-1 | INHIBIDOR DE GONADOTROPINA | |||
| BUSULFÁN | 55-98-1 | AGENTE ALQUILANTE | 1 | Mutagénico en varios sistemas experimentales | |
| CAPECITABINA | 154361-50-9 | ANTIMETABOLITO | |||
| CARBOPLATINO | 41575-94-4 | AGENTE ALQUILANTE | En animales mutagénico y teratogénico. Compuestos con mecanismo similar a los carcinógenos | ||
| CARMUSTINA | 154-93-8 | AGENTE ALQUILANTE | 2A | ||
| CETUXIMAB | 205923-56-4 | ANTICUERPO MONOCLONAL | |||
| CICLOFOSFAMIDA | 50-18-0 | AGENTE ALQUILANTE | 1 | Citotóxico, Citostático | |
| CICLOFOSFAMIDA MONOHIDRATO | 6055-19-2 | AGENTE ALQUILANTE | 1 | Citotóxico, Citostático | |
| CICLOSPORINA | 59865-13-3 | INMUNOSUPRESOR | |||
| CISPLATINO | 15663-27-1 | AGENTE ALQUILANTE | 2A | 0,00005 mg/m3 (Países Bajos) | Efectos carcinogénicos y mutagénicos en animales de laboratorio. Aberraciones cromosómicas en cultivos de células animales |
| CITARABINA | 147-94-4 | INHIBIDOR CRECIMIENTO CELULAR | |||
| CLADRIBINA | 4291-63-8 | INMUNOSUPRESOR(2) | Potencial mutagénico. Teratógeno en ratones y conejos | ||
| CLORAMBUCILO | 305-03-3 | AGENTE ALQUILANTE | 1 | ||
| CLORANFENICOL | 56-75-7 | ANTIBIÓTICO | |||
| CLORNAFACINA | 494-03-1 | AGENTE ALQUILANTE | 1 | ||
| CLOROMETINA-N-ÓXIDO | 126-85-2 | AGENTE ALQUILANTE | 2B | ||
| CLOROZOTOCINA | 54749-90-5 | AGENTE ALQUILANTE | 2A | ||
| DACARBACINA | 04342-03-04 | AGENTE ALQUILANTE | 2B | 0,0009 mg/m3 (Países Bajos) | Citotóxico. Efectos carcinogénicos, mutagénicos y teratogénicos en sistemas de pruebas experimentales |
| DAUNOMICINA | 20830-81-3 | AGENTE ALQUILANTE | 2B | ||
| DAUNORUBICINA HCl | 23541-50-6 | INHIBIDOR CRECIMIENTO CELULAR | Carcinogénica en experimentos in vivo. Mutagénica in vivo e in vitro | ||
| DENILEUKINA | 173146-27-5 | INHIBIDOR CRECIMIENTO CELULAR | |||
| DIETILESTILBESTROL | 56-53-1 | HORMONAL | 1 | ||
| DOCETAXEL | 114977-28-5 | INHIBIDOR CRECIMIENTO CELULAR | Puede dañar la fertilidad masculina | ||
| DOXORUBICINA | 23214-92-8 | INHIBIDOR CRECIMIENTO CELULAR | Naturaleza citotóxica. Genotóxico en animales | ||
| EPIRUBICINA | 56420-45-2 | ANTIBIÓTICO | Mutagénico, embriotóxico, genotóxico y carcinogénico en animales | ||
| EPIRUBICINA HCl | 56390-09-1 | ANTIBIÓTICO | |||
| ERLONTINIB | 183321-74-6 | INHIBIDOR DE LA TIROSINA QUINASA | |||
| ESTRAMUSTINA | 2998-57-4 | AGENTE ALQUILANTE | Potencialmente carcinogénico, mutagénico y tóxico para la reproducción | ||
| ESTREPTOZOTOCINA | 18883-66-4 | ANTIMETABOLITO | 2B | ||
| ETOGLUCIDO | 1954-28-5 | AGENTE ALQUILANTE | 3 | ||
| ETOPÓSIDO | 33419-42-0 | INHIBIDOR DE LA TOPOSIOMERASA | 2A | Mutagénico, genotóxico, teratógeno y embriotóxico en animales | |
| ETOPÓSIDO | 117091-64-2 | INHIBIDOR DE LA TOPOSIOMERASA | 2A | ||
| FOSFATO | |||||
| ETOPOSIDO + | |||||
| CIS-PLATINO + | 1 | ||||
| BLEOMICINA | |||||
| EXEMESTANO | 107868-30-4 | HORMONAL | |||
| FLOXURIDINA | 50-91-9 | INHIBIDOR CRECIMIENTO CELULAR | |||
| FLUDARABINA | 75607-67-9 | INHIBIDOR CRECIMIENTO CELULAR | Potencialmente carcinógeno. Efectos teratogénicos en humanos | ||
| 5-FLUOROURACILO | 51-21-8 | ANTIMETABOLITO | 3 | Mujeres embaradas NO manipular. Efectos carcinogénicos y teratógenos en animales | |
| FLUTAMIDA | 13311-84-7 | HORMONAL | |||
| FULVESTRANT | 50-28-2 | HORMONAL | |||
| GANCICLOVIR | 82410-32-0 | ANTIVIRAL | |||
| GEFITINIB | 184475-35-2 | INHIBIDOR DE LA TIROSINA QUINASA | Potencialmente fototóxico | ||
| GEMCITABINA | 122111-03-9 | INHIBIDOR CRECIMIENTO CELULAR | Toxicidad reproductiva en animales. Mutagénico en estudio de mutaciones in vitro | ||
| GEMTUZUMAB | 220578-59-6 | ANTICUERPO MONOCLONAL | |||
| GOSERELINA | 70280-59-0 | R. AGONISTA | |||
| HIDROXIUREA | 127-07-1 | ANTIMETABOLITO | 3 | Riesgo carcinogenicidad en humanos. Potencialmente mutagénica | |
| IBRITUMOMAB TIUXETAN | 206181-63-7 | ANTICUERPO MONOCLONAL | |||
| IDARUBICINA | 58957-92-9 | ANTIBIÓTICO | |||
| IFOSFAMIDA | 3778-73-2 | AGENTE ALQUILANTE | 3 | ||
| IMATINIB | 152459-95-5 | INHIBIDOR CRECIMIENTO CELULAR | |||
| IMATINIB MESILATO | 220127-57-1 | INHIBIDOR CRECIMIENTO CELULAR | |||
| INTERFERON ALFA-2a | 76543-88-9 | INHIBIDOR CRECIMIENTO CELULAR | |||
| INTERFERON ALFA-2b | 99210-65-8 | INHIBIDOR CRECIMIENTO CELULAR | |||
| INTERFERON ALFA-n1 | 74899-72-2 | INHIBIDOR CRECIMIENTO CELULAR | |||
| INTERFERON ALFA-n3 | 9008-11-1(3) | INHIBIDOR CRECIMIENTO CELULAR | |||
| IRINOTECAN | 97682-44-5 | INHIBIDOR DE LA TOPOISOMERASA I | |||
| LEFLUNOMIDA | 75706-12-6 | INHIBIDOR CRECIMIENTO CELULAR | |||
| LETROZOL | 112809-51-5 | INHIBIDOR DE LA AROMATASA | |||
| LEUPRORELINA ACETATO (LEUPROLIDA) | 74381-53 | HORMONAL | |||
| LOMUSTINA | 13010-47-4 | AGENTE ALQUILANTE | 2A | ||
| LONIDAMIDA | 50264-69-2 | INHIBIDOR CRECIMIENTO CELULAR | |||
| MANOMUSTINA | 576-68-1 | AGENTE ALQUILANTE | 3 | ||
| MANOMUSTINA HCl | 551-74-6 | AGENTE ALQUILANTE | 3 | ||
| MECLORETAMINA | 51-75-2 | AGENTE ALQUILANTE | 2A | ||
| MECLORETAMINA HCl | 55-86-7 | AGENTE ALQUILANTE | 2A | Altamente tóxico | |
| MEDFALAN | 13045-94-8 | AGENTE ALQUILANTE | 3 | ||
| MEDROXIPROGESTERO NA | 520-85-4 | HORMONAL | |||
| MEGESTROL ACETATO | 595-33-5 | HORMONAL | |||
| MELFALÁN | 148-82-3 | AGENTE ALQUILANTE | 1 | Citotóxico. Mutagénico en animales. Se han observado aberraciones cromosómicas en el hombre | |
| MERCAPTOPURINA ANHIDRA | 50-44-2 | INHIBIDOR CRECIMIENTO CELULAR | 3 | ||
| MERCAPTOPURINA MONOHIDRATO | 6112-76-1 | INHIBIDOR CRECIMIENTO CELULAR | |||
| METOTREXATO | 59-05-2 | ANTIMETABOLITO | 3 | Citotóxico. No clasificable en carcinogenicidad para humanos. Daño cromosómico en células somáticas animales, células de la médula ósea humanas. En animales: embriotóxico, fetotóxico y teratogénico | |
| MERFALAN | 531-76-0 | AGENTE ALQUILANTE | 2B | ||
| MICOFENOLATO | 24280-93-1 | INMUNOSUPRESOR | |||
| MITOMICINA C | 50-07-7 | AGENTE ALQUILANTE | 2B | Evitar contacto piel y ojos. Agente mutágeno y clastogénico. Posible carcinogéno en humanos. Riesgo potencial de toxicidad para la reproducción en humanos | |
| MITOTANO | 53-19-0 | INHIBIDOR CRECIMIENTO CELULAR | |||
| MITOXANTRON | 65271-80-9 | INHIBIDOR DE LA TOPOSIOMERASA | 2B | Citotóxico. Agente potencialmente teratógeno por su mecanismo de acción. Actividad mutagénica | |
| MITOXANTRON Di HCl | 70476-82-3 | INHIBIDOR CRECIMIENTO CELULAR | 2B | ||
| OXIDO DE MECLORETAMINA HCl | 302-70-5 | AGENTE ALQUILANTE | 2B | ||
| MOSTAZA URACILO | 66-75-1 | AGENTE ALQUILANTE | 2B | ||
| NILUTAMIDA | 63612-50-0 | HORMONAL | |||
| OXALIPLATINO | 61825-94-3 | INHIBIDOR CRECIMIENTO CELULAR | Probablemente carcinógeno. Mutagénico y clastógeno en células de mamíferos. Produce toxicidad embriofetal en ratas | ||
| PACLITAXEL | 33069-62-4 | INHIBIDOR DE MICROTÚBULOS | Agente potencialmente carcinógeno y genotóxico. Se ha demostrado ser mutagénico in vivo e in vitro | ||
| PEGASPARGASA | 130167-69-0 | INHIBIDOR CRECIMIENTO CELULAR | |||
| PEMETREXED | 150399-23-8 | INHIBIDOR CRECIMIENTO CELULAR | |||
| PENTAMIDINA | 140-64-7 | ANTIBIÓTICO | |||
| PENTOSTATIN | 53910-25-1 | ANTIMETABOLITO | |||
| PIPOBROMAN | 54-91-1 | AGENTE ALQUILANTE | |||
| PICAMICINA | 18378-89-7 | INHIBIDOR CRECIMIENTO CELULAR | |||
| PREDNIMUSTINA | 29069-24-7 | AGENTE ALQUILANTE | 3 | ||
| PROCARBACINA HCl | 366-70-1 | AGENTE ALQUILANTE | 2A | 0,002 mg/m3 (Países Bajos) | Carcinogenicidad en animales. Poder mutagénico en animales |
| RALTITREXED | 112887-68-0 | INHIBIDOR DE TIMIDILATO SINTASA | Citotóxico | ||
| RIBAVIRINA | 36791-04-5 | ANTIVIRAL | |||
| RITUXIMAB | 174722-31-7 | ANTICUERPO MONOCLONAL | Potencialmente mutagénico | ||
| SEMUSTINA | 13909-09-6 | AGENTE ALQUILANTE | 1 | ||
| SIROLIMUS | 53123-88-9 | INHIBIDOR CRECIMIENTO CELULAR | |||
| TACROLIMUS | 104987-11-3 | INMUNOSUPRESOR | |||
| TAMOXIFENO | 10540-29-1 | ANTIESTRÓGENO | 1 | ||
| TEMOZOLOMIDA | 85622-93-1 | AGENTE ALQUILANTE | |||
| TENIPOSIDE | 29767-20-2 | INHIBIDOR DE LA TOPOSIOMERASA | 2A | ||
| TESTOLACTONA | 968-934 | INHIBIDOR CRECIMIENTO CELULAR | |||
| TESTOSTERONA | 58-22-1 | HORMONAL | 2A | ||
| TETRAMINA | 51-18-3 | AGENTE ALQUILANTE | 3 | ||
| TIOGUANINA | 154-42-7 | INHIBIDOR CRECIMIENTO CELULAR | 2B | ||
| TIOTEPA | 52-24-4 | AGENTE ALQUILANTE | 1 | ||
| TOPOTECAN | 123948-87-8 | INHIBIDOR DE LA TOPOSIOMERASA | |||
| TOPOTECAN HCl | 119413-54-6 | INHIBIDOR DE LA TOPOSIOMERASA | |||
| TOREMIFENO | 89778-26-7 | HORMONAL | |||
| TOREMIFENO CITRATO | 89778-27-8 | HORMONAL | |||
| TOSITUMOMAB | 192391-48-3 | ANTICUERPO MONOCLONAL | |||
| TRASTUZUMAB | 180288-69-1 | ANTICUERPO MONOCLONAL | |||
| TREOSULFÁN | 299-75-2 | AGENTE ALQUILANTE | 1 | ||
| TRIAZIQUON | 68-76-8 | AGENTE ALQUILANTE | 3 | ||
| TRICLORMETINA | 817-09-4 | AGENTE ALQUILANTE | 2B | ||
| TRIPTORELINA | 57773-63-4 | HORMONAL | |||
| URAMUSTINA | 66-75-1 | AGENTE ALQUILANTE | 2B | ||
| VALRUBICINA | 56124-62-0 | INHIBIDOR CRECIMIENTO CELULAR | |||
| VINBLASTINA SULFATO | 143-67-9 | INHIBIDOR DE LOS MICROTÚBULOS | 3 | Citotóxico. Puede presentar efectos teratógenos en animales | |
| VINCRISTINA SULFATO | 2068-78-2 | INHIBIDOR DE LOS MICROTÚBULOS | 3 | Efectos teratógenos en animales | |
| VINDESINA | 53643-48-4 | INHIBIDOR DE LOS MICROTÚBULOS | Efectos teratógenos en animales | ||
| VINORELBINA | 71486-22-1 | INHIBIDOR CRECIMIENTO CELULAR | Puede producir efectos genotóxicos en humanos |
(1) Clasificación IARC. 1: El agente (mezcla, actividad laboral) es cancerígeno para los humanos.
2A: El agente es probablemente cancerígeno para los humanos.
2B: El agente es posiblemente cancerígeno para los humanos.
3: El agente no es clasificado como cancerígeno para los humanos.
4: El agente probablemente no es cancerígeno para los humanos.
(2) Inhibidor de la ribonucleótidoreductasa y ADN polimerasa.
(3) El CAS 9008-11-1 se utiliza como número de registro genérico para el interferón alfa.